置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。它是一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应。
氧化还原反应不一定为置换反应,置换反应一定为氧化还原反应。
置换反应及应用
1、概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应是置换反应。
表示为:A+BC=AC+B
例如:Fe+CuSO4===Cu+FeSO4(Fe和Cu为单质,CuSO4和FeSO4为化合物)
目前为止,我们已经学习了四大基本反应类型中的三种,分别为化合反应,分解反应,置换反应。要会判断反应类型。
例如:C+O2==点燃==CO2 化合反应
H2O==通电==H2↑+O2↑ 分解反应
H2+CuO==高温==Cu+H2O 置换反应
2、金属与盐溶液的反应
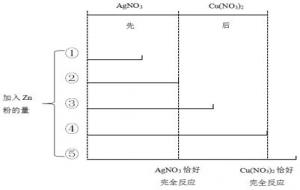
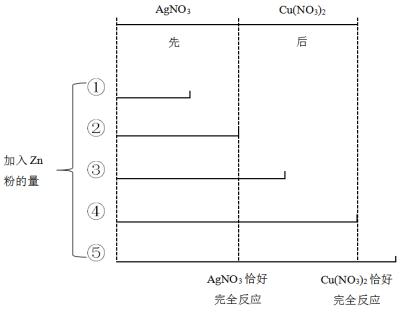
(1)在活动性顺序中,金属的距离大的,反应先发生。一个置换反应结束后,另一个置换反应才会发生。
例如:向硝酸银和硝酸铜的混合溶液中加入锌粉,加入锌粉的量不同,滤液和滤渣的成分不一样。
|
滤液成分 |
滤渣成分 |
|
|
① |
Zn(NO3)2、Cu(NO3)2、AgNO3 |
Ag |
|
② |
Zn(NO3)2、Cu(NO3)2 |
Ag |
|
③ |
Zn(NO3)2、Cu(NO3)2 |
Ag、Cu |
|
④ |
Zn(NO3)2 |
Ag、Cu |
|
⑤ |
Zn(NO3)2 |
Ag、Cu、Zn |
(2)比较Al、Fe、Cu、Ag金属的活动性
|
操作 |
现象 |
反应的化学方程式 |
|
铁丝浸入硫酸铜溶液中 |
浸入溶液的铁钉表面覆盖一层红色的物质,溶液由蓝色逐渐变为浅绿色 |
Fe+CuSO4= Cu+FeSO4 |
|
铝丝浸入硫酸铜溶液中 |
浸入溶液的铝丝表面覆盖一层红色的物质,溶液由蓝色 逐渐变为无色 |
2Al+3CuSO4= 3Cu+Al2(SO4)3 |
|
铜丝浸入硝酸银溶液中 |
浸入溶液的铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变为蓝色 |
Cu+2AgNO3= 2Ag+Cu(NO3)2 |
|
铜丝浸入硫酸铝溶液中 |
无现象 |
不反应 |
结论:1.以上四种金属的活动性由强到弱的顺序为:Al>Fe>Cu>Ag
2. 活泼性强的金属能把活泼性弱的金属从其化合物溶液中置换出来。
注意:1.此类反应一定在溶液中进行,不溶于水的化合物一般不与金属反应。
2. K、Ca、Na活动性非常强,但不能用它们置换化合物中的金属,因为它们能同溶液中的水剧烈反应