泛素化是指泛素(一类低分子量的蛋白质)分子在一系列特殊的酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,并对靶蛋白进行特异性修饰的过程。这些特殊的酶包括泛素激活酶、结合酶、连结酶和降解酶等。
导读:《自然》:改写教科书!科学家首次发现,泛素化底物竟然可以不是蛋白质丨科学大发现
朋友们!
咱们的认知又要被刷新了!
近日,英国剑桥大学MRC分子生物学实验室的Elsje G. Otten和Felix Randow及其团队,在研究细胞抗细菌感染机制的过程中偶然发现,泛素化的底物竟然还可以不是蛋白质,而是一种脂多糖。[1]
如此看来,咱们的教科书又要修改了!考试知识点又双叒要增加了!
相关成果发表于顶级期刊《自然》杂志。

论文首页截图
说起泛素化,大家肯定不陌生。它是真核生物中一种广泛存在的蛋白质翻译后修饰,帮助细胞降解有问题的蛋白质。它在细胞周期调控、细胞凋亡、细胞信号转导等诸多生命活动都发挥着重要的作用。[2]
一般情况下,泛素化的过程如下:泛素先由E1活化酶活化,而后被转移到E2结合酶,最后由E2结合酶转交给E3连接酶,E3连接酶找到蛋白底物完成泛素化修饰。
那么Otten和Randow团队是如何发现脂多糖也可以是泛素化的底物的呢?
其实,Otten和他的同事一开始也不是奔着研究泛素化去的。他们是想搞清楚人体细胞究竟是如何清除沙门氏菌感染的。
之前的研究已经发现,细胞在清除进入细胞内的沙门氏菌时,首先会启动泛素化过程,给沙门氏菌打上“垃圾”的标签,然后细胞会启动自噬的功能,清除“垃圾”。[3-5]
这个过程看上去虽然简单,但是研究人员并不清楚它究竟是如何发生的。或者说不清楚背后的分子机制。[6-9]
Otten和他的同事就是想解开这个谜题。
为了解开这个谜题,研究者们利用结构光照明显微镜和免疫印记法,研究了宿主细胞抗沙门氏菌感染的过程。
研究结果让他们大吃一惊。
因为他们发现,泛素化的位点竟然是细菌膜表面的脂质成分——脂多糖 (LPS) 分子。
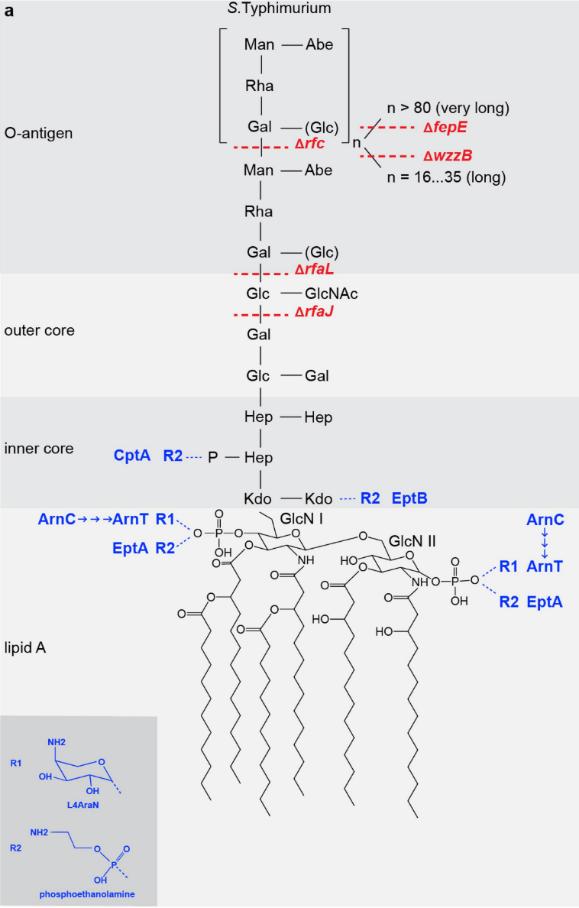
脂多糖常在细菌致病性中起主要作用,在细菌外膜中由脂质 A、寡糖和O-抗原组成。[10]
看到这样的研究结果,估计不管是谁都不敢相信。
为了证明自己没有出错,研究者们设计了一系列实验来反复验证这个实验结果。
结果他们一遍又一遍地得到同一个结论:脂多糖这个非蛋白质真的是泛素化底物!
这一发现可谓是“无心插柳柳成荫”!就像电影里的常用情节,好好的地质勘探,结果挖出来了个沉睡的外星人或者Captain American这个老冰棍(?)!
既然已经证实了脂多糖也可以被泛素化,那这个过程究竟是如何发生的呢?
利用泛素化酶(来自人类宿主细胞的提取物)以及不同菌株的细菌,研究者们设计了一个体外重建泛素化事件的实验。
果然,结果再次证明,人类宿主细胞在抗沙门氏菌感染时的泛素化底物是脂多糖,并且确定了泛素化修饰的具体位点是脂多糖上的脂质A,作用位点可能是羟基、磷酸基团。
既然已经找到了细菌表面被泛素化的“靶子”,那紧接着就是寻找那个“口味独特”的E3连接酶。
接下来,研究者们对HeLa细胞裂解物进行了各种分离纯化,并进行了质谱分析。层层分析过后,终于在茫茫人海之中找到了那个人,不对,那个蛋白质。蛋白质RNF213就是那个以脂多糖为泛素化底物的E3连接酶。
那RNF213是个什么人物?已有研究表明,RNF213是一种新型(591kDa)E3泛素连接酶,它的E3连接酶活性结构域包括RZ结构域、RING结构域和动力蛋白样的AAA+结构域。其中RING结构域的缺失对RNF213的E3连接酶活性没有明显影响;相比之下,AAA+结构域和RZ结构域对其E3连接酶活性则至关重要。[11]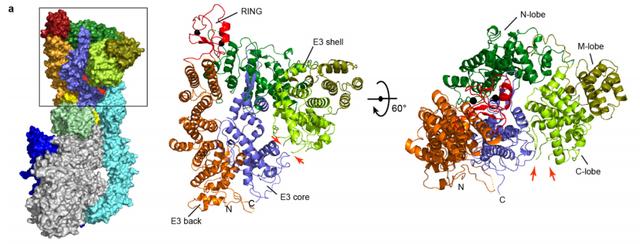
RNF213的结构域。N-lobe、 M-lobe、C-lobe分别表示N端、中间和C端。红色箭头指向为RZ结构域。
也就是说,RNF213作为E3连接酶以脂多糖为泛素化底物,参与了细胞抗细菌感染中由泛素化修饰介导的自噬机制。
在随后的研究中,研究人员还发现,RNF213在将泛素连接到脂多糖分子上之后,还可以通过另一种E3连接酶进一步放大泛素化信号,促进沙门氏菌被自噬清除。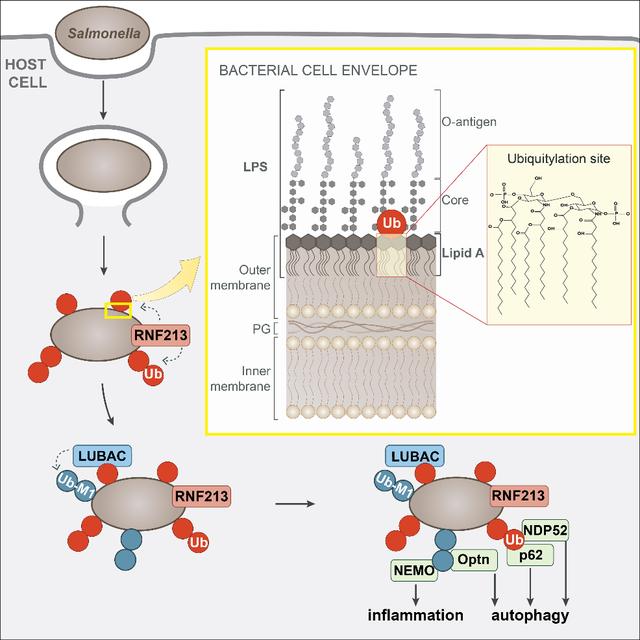
RNF213通过直接(对脂多糖的泛素化)和间接(以脂多糖的泛素化来招募LUBAC[8])在细菌表面形成泛素化涂层。
总体来说,研究者们完成了对抗细菌感染机制的进一步探索——RNF213以脂多糖为泛素化底物,介导了宿主细胞抗细菌感染中的泛素化依赖性自噬行为。同时,这个研究还对泛素化研究领域进行了重大完善和拓展——泛素化的底物不限于蛋白质,也可以是非蛋白质。
这个发现或许还会拓宽基于泛素化过程的药物研发思路。
正如美国国家科学院院士Carolyn Bertozzi发的推文所说“一旦脱离了‘蛋白质’这一思维限制,还会出现更多有趣的发现!”
让我们拭目以待吧!
参考文献:
[1]Otten, E.G., Werner, E., Crespillo-Casado, A. et al. Ubiquitylation of lipopolysaccharide by RNF213 during bacterial infection. Nature 594, 111–116 (2021).
[2]Swatek, K., Komander, D. Ubiquitin modifications. Cell Res 26, 399–422 (2016).
[3]Huang, J. & Brumell, J. H. Bacteria–autophagy interplay: a battle for survival. Nat. Rev. Microbiol. 12, 101–114 (2014).
[4]Perrin, A. J., Jiang, X., Birmingham, C. L., So, N. S. Y. & Brumell, J. H. Recognition of bacteria in the cytosol of mammalian cells by the ubiquitin system. Curr. Biol. 14, 806–811 (2004).
[5]Deretic, V., Saitoh, T. & Akira, S. Autophagy in infection, inflammation and immunity. Nat. Rev. Immunol. 13, 722–737 (2013).
[6]Huett, A. et al. The LRR and RING domain protein LRSAM1 is an E3 ligase crucial for ubiquitin-dependent autophagy of intracellular Salmonella Typhimurium. Cell Host Microbe 12, 778–790 (2012).
[7]Manzanillo, P. S. et al. The ubiquitin ligase parkin mediates resistance to intracellular pathogens. Nature 501, 512–516 (2013).
[8]Noad, J. et al. LUBAC-synthesized linear ubiquitin chains restrict cytosol-invading bacteria by activating autophagy and NF-κB. Nat. Microbiol. 2, 17063 (2017)
[9]Franco, L. H. et al. The ubiquitin ligase Smurf1 functions in selective autophagy of Mycobacterium tuberculosis and anti-tuberculous host defense. Cell Host Microbe 21, 59–72 (2017).
[10]Raetz, C. R. H. & Whitfield, C. Lipopolysaccharide endotoxins. Annu. Rev. Biochem. 71, 635–700 (2002).
[11]Ahel, J. et al. Moyamoya disease factor RNF213 is a giant E3 ligase with a dynein-like core and a distinct ubiquitin-transfer mechanism. eLife 9, e56185 (2020).
本文作者 张艾迪


